File 1
docx Please login to download this file.File 2
pdf Please login to download this file.د کيمياوي رابطو جوړولو سره د اتومونه يو ځای کیدل
د ځمکې پر مخ د ټولو مادو او شیانو د رامنځته کیدو لپاره اتومونه بايد اتحاد وکړي. اتومونه يوازې ۱۰۰ بيلابيل ډولونه لري خو د مادې د ډولونو هغه تنوع چې له دې اتحاد څخه رامنځته کیږي د اتومونو د تنوع په پرتله ډیر پراخ دی. دا ټولې مادې د هغو پیوندونو په مرسته جوړې شوي دي چې اتومونه یې سره تړلي دي. دې پيوندونو ته Bonds يا رابطې وايي. کيمیاوي رابطې د يوه پل په څير حقيقي جوړښت نه لري، بلکې يو ډول کيمیاوي جاذبه ده چې له يوه څخه زيات اتومونه سره يو ځای نیسي. د کيمیاوي رابطو دوه عام ډولونه آیوني او کوولانسي رابطې دي.
ددې لپاره چې د کيمياوي رابطو پر مفهوم ښه پوه شو، اړينه ده چې د اتوم پر جوړښت ځانونه ښه پوه کړو. اتوم له درې کوچنیو برخو څخه جوړ شوی دی چې پروټون، نيوټرون او اليکترون يې بولي. پروټونونه او نيوټرونونه د اتوم په مرکزي برخه کې موقيعیت لري خو الیکترون د اتوم په بهرنۍ برخه کې مدارونه وهي. الکترون ډیر کوچنی جسامت او منفي چارج لري. الیکترون د هستې چاپیره مدارونه په ترتیب سره ډکوي. الیکترون لومړی هغه مدار ډکوي چې هستې نه نږدې دی او بيا همداسې د بهر لورته ادامه پيدا کوي. اتومونه هغه وخت زیات ثابت وي چې تر ټولو وروستی مدار یې له اليکترون څخه ډک وي. د اتوم د تر ټولو وروستي مدار اليکترونونه هغه یوازيني اليکترونونه دي چې د نورو اتومونو له الیکترونونو سره تعامل کوي. له دې کبله اتومونه د کيمياوي رابطو په جوړولو سره په بهرني مدار کې الیکترونونه له لاسه ورکوي، اخلي او يا يې شريکوي چې وروستی مدار ډک وساتي.
د اتوم ځينې ډولونه پخپل وروستي مدار کې د الیکترونونو بشپړ شمير لري. دا ډول اتومونه ډیر ثابت وي او له نورو اتومونو سره رابطې نه جوړوي. بيلګې يې نجيبه ګازونه لکه هيليوم او نيون دي. څرنګه چې هيليوم د کیمياوي تعامل په برخه کې ډیر غیر فعال دی له دې کبله د ګرمې هوا د بالونونو د ډکولو لپاره یو خوندي او مناسب انتخاب بلل کیږي.
آیوني رابطې هغه وخت رامنځته کیږي چې یو ډول اتوم خپل الیکترون له لاسه ورکړي او بل ډول اتوم يې واخلي. دا کار د اتوم د دواړو ښکيلو ډولونو لپاره ګټور دی. ځکه چې دا کار له دوی سره د وروستي مدار په ډکولو او ثابت پاتې کیدو کې مرسته کوي. د آیوني مرکب يوه بيلګه سوډيم کلورايډ دی چې د الیکترونونو په ورکولو او اخيستلو سره رامنځته کیږي. سوډيم (Na) یو داسې اتوم دی چې د خپل ثبات لپاره يوه الیکترون ته اړتیا لري. کلورين (Cl) هغه اتوم دی چې یو اضافه الیکترون لري او د خپل ثبات لپاره یې بايللو ته اړتیا لري. دا ستونزه هغه وخت حل کیږي چې د دواړو عناصرو اتومونه خپل منځ کې تعامل وکړي او يوه آیوني رابطه جوړه کړي. د دوی د تعامل په پایله کې رامنځته شوی مرکب د سوډيم کلورایډ (NaCl) يا د خوړو مالګې په نامه ياديږي.
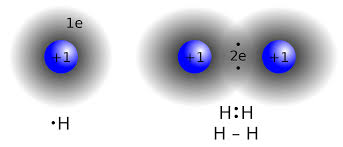
د کيمياوي رابطو يو بل عام ډول کوولانسي رابطې دي. کوولانسي رابطې هغه وخت رامنځته کیږي چې د دوه اتومونو تر منځ الیکترونونه شریک شي. بيا هم دا ډول رابطه د مدارونو په ډکولو سره، د دواړو اتومونو په ثبات کې مرسته کوي. کله چې اتومونه سره يو ځای شي او کوولانسي رابطه جوړه کړي په پایله کې يې مالیکول رامنځته کيږي. مالیکول د اوبو، بورې او کاربن ډای اوکسايډ په ګډون ګڼې بيلګې لري. زموږ د بدن هر يو نسج داسې مالیکولونه لري چې د کوولانسي رابطو په مرسته سره نیول شوي دي.
About this resource
Publisher
License
