File 1
docx Please login to download this file.File 2
pdf Please login to download this file.کیمياوي رابطې
يوه کيمياوي رابطه هغه جاذبې ته وايي چې د اليکترونونو د شريکولو او يا بشپړ انتقال په پايله کې د دوه اتومونو تر منځ رامنځته کیږي. درې ډوله کیمياوي رابطې موجودې دي: چې آيوني، کولانټ او قطبي کولانټ رابطې په کې شاملې دي. پر دې برسيره کیمياپوهانو يو بل ډول کيمياوي رابطه هم تشخيص کړې ده چې د هايدروجن رابطې په نامه يې يادوي.
آيوني رابطه
آيوني رابطې د هغو الیکترون اخيستونکو (بهرنی مدار يې خالي وي) عناصرو څخه رامنځته کیږي چې الیکټرون ورکونکو (بهرنی مدار يې زياتره وخت ډک وي) عناصرو سره تعامل وکړي. په دې صورت کې اليکترونونه په بشپړه توګه انتقال کوي. ددې رابطې يوه ښه بیلګه خوراکي مالګه يا سوډيم کلورايډ دی. سوډیم د خپل وروستي مدار ټول الیکترونونه کلورين ته ورکوي چې يوازې يوه الیکترون ته اړتیا لري. په دې توګه د دې اتومونو تر منځ جاذبه ساکنې بريښنا په څیر ده، ځکه چې مخالف چارجونه یو بل جذبوي.
کوولانسي رابطې
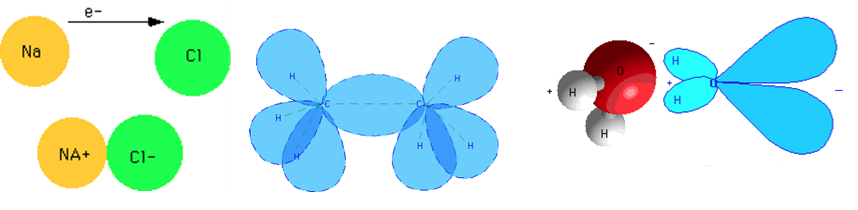
کوولانسي رابطې د اليکترونونو بشپړ شریکول په بر کې نیسي او معمولا د هغو اتومونو په منځ کې رامنځته کیږي چې وروستی مدار او يا د انرژي کچه یې نیمايي ډکه شوې وي. په دې توګه که اتومونه الیکترون اخيستنې له پلوه سره برابر وي بيا اليکټرون شریک کیدای شي. کاربن کوولانسي رابطې جوړوي. اليکترونونه په يو هايبريد مدار کې ځای لري چې د ښکيلو اتومونو له خوا رامنځته کیږي لکه په ايتان کې یې ليدلی شو. الماس ځکه ډیر کلک دی چې د کاربن د اتومونو تر منځ يې د کوولانسي رابطو پراخه شبکه موجوده وي.
قطبي کوولانسي رابطې
دا رابطې د کوولانسي او آیوني رابطو تر منځ ځای لري چې اتوم پکې الیکترونونه شریکوي خو اليکترون د مرکب د نورو اتومونو په پرتله زیاتره د يوه اتوم شاو خوا راټوليږي. دا ډول رابطه هغه وخت رامنځته کیږي چې د ښکيلو اتومونو په اليکټرون اخيستنې کې لوی توپير موجود وي. تر ټولو پيژاندل شوې بيلګه يې د اوبو مرکب دی. اکسيجن د هايدروجن په پرتله زيات اليکټرون اخيستونکی دی، له دې کبله هغه اليکترونونه چې د اوبو د رابطو په جوړولو کې ښکيل دي زیاتره وخت له اکسيجن سره تيروي. دا حقيقت چې د اوبو ماليکول قطبي کوولانسي رابطه لري پر هغو مالیکولونو ځانګړې اغيز کوي چې په اوبو کې حل کیږي. په ځانګړي توګه، هغه
مالیکولونه چې قطبی کوولانسي رابطې لري د اوبو له ماليکول سره د يو ځای کیدو پر مهال ټوټه کیږي. دا مالیکولونه په مخالفو چارجونو کې د جاذبې له کبله ټوټه کیږي. څرنګه چې په آیوني رابطو کې د مخالف چارج آیونونه ښکيل دي، اوبه له خپلو قطبي کوولانسي رابطو څخه په استفادې سره کولی شي چې آیونونه له يو بل څخه جلا او بيا د آیونونه د محاصرې له لارې ددې آیونونو له بيا يو ځای کیدو څخه مخنيوی وکړي. د اوبو ټول خواص له دې کوولانسي رابطو سره اړه لري. له بيلابیلو عضوي مرکباتو سره د اوبو د تعامل ميلان او نه میلان په اوبو کې د موجودو کوولانسي رابطو پورې اړه لري.
هايدروجني رابطې
دا حقیقت چې د اوبو د مالیکول اکسيجني پای منفي چارج او هايدروجني پای يې مثبت چارج لري په دې معنی دی چې د یوه مالیکول اوبو هايدروجن د خپل ګاونډي مالیکول اکسيجن جذبوي او هغه بل پای د دې برعکس کار کوي.
دا ځکه چې مخالف چارجونه يو بل سره جذبوي. دې لویې الیکټرو سټاټیک جاذبې ته هایدروجنی رابطه وايي او د اوبو د ګڼو ځانګړتیاو په تعينولو کې مهم دي چې اوبه يې د ژوند لپاره يوه مهمه مایع ګرځولې ده. اوبه دا ډول رابطې له نورو قطبي مالیکولونو او يا آیونونو لکه د هايدروجن او يا د سوډيم له آيون سره هم جوړوي. پر دې سربيره، د هايدروجن رابطې د نورو مالیکولونو تر منځ او په منځ کې هم رامنځته کیږي.
د بيلګې په توګه، د ډي اين اې DNA د مالیکول دوه ځنځيرونه د هايدروجنې رابطې په مرسته نیول شوي دي. د اوبو د ماليکولونو او د يوه پروټين د امینو اسيدونو تر منځ هایدروجني رابطې د پروټين د بڼې په ساتلو کې مهم رول لري. دغه شکل د اوبو د ماليکولونو د يوې کوچنۍ ډلې نمایندګي کوي. په لاندې شکل کې د مخالفو چارجونو تر منځ جوړې شوې هايدروجني رابطې د یو لړ کرښو له لارې ښودل شوي دي چې ویکتور نه لري. غبرګې کرښې دا حقیقت ښيي چې مشابه چارجونه يو بل دفع کوي. هايدروجني رابطې او دفعه کوونکې قواوې يو بل انډول کوي او دواړه د اوبو د خواصو په تعينولو کې مرسته کوي.
About this resource
Resource type
Publisher
License
